
Resumen
Esta investigación se basa en la determinación de la cantidad de principio activo presente en diferentes formulaciones farmacéuticas de ibuprofeno. En la actualidad, existe una creencia generalizada sobre una menor eficacia de las formulaciones farmacéuticas genéricas frente a las referentes de marca registrada, lo que conduce a muchas personas a adquirir el medicamento más costoso, pues relacionan directamente su precio con un mejor funcionamiento del mismo. No obstante, con este estudio se pretende evaluar las diferencias existentes entre la cantidad de principio activo obtenida experimentalmente y el valor etiquetado por el fabricante (600 mg).
Con el fin de garantizar una exploración centrada y bien fundamentada de métodos para obtener información y delimitar el alcance de esta, la investigación se basó en llevar a la práctica, en concreto, al laboratorio, los conceptos estudiados sobre las reacciones de neutralización. Así, el método escogido fue la volumetría ácido-base para, a partir del volumen gastado de hidróxido de sodio en cada valoración, hallar la cantidad de ibuprofeno contenida en cada pastilla de las cinco marcas escogidas. Tras el análisis de los resultados se puede observar que no existe una variación considerable entre las cantidades obtenidas experimentalmente y el valor etiquetado, pero en ningún caso lo iguala.
Índice
1. Introducción

Probablemente, una de las medicinas más populares hoy en día es el ibuprofeno. El dolor es un mecanismo imprescindible de nuestro organismo, pues es el modo que este tiene de saber que está sufriendo un daño y que es necesario actuar al respecto. La importancia del dolor es evidente al observar a personas que son incapaces de sentir el dolor físico, es decir, nacen con la denominada "insensibilidad congénita al dolor" y, como consecuencia, sufren diversas heridas en el cuerpo, huesos rotos y otros problemas de salud. Aunque, con frecuencia, el dolor puede volverse molesto, esta sensación aflictiva es indispensable para el funcionamiento normal de nuestro cuerpo.
El ibuprofeno es un fármaco antiinflamatorio no esteroideo (AINE) empleado para aliviar el dolor, la inflamación y disminuir la temperatura corporal. Este medicamento actúa inhibiendo las ciclooxigenasas (COX), enzimas involucradas en los procesos de dolor, capaces de convertir el ácido araquidónico, que liberan las células cuando sufren un daño, en prostaglandinas.
2. Objetivo
Mi propósito al llevar a cabo esta investigación es evaluar, mediante métodos de análisis químico, la concentración de ibuprofeno en cinco marcas diferentes de comprimidos de 600 mg, con el fin de comprobar si existen diferencias entre el contenido teórico y el obtenido de forma práctica en una volumetría ácido-base.
3. Metodología
Para determinar experimentalmente la cantidad de Ibuprofeno contenida en cada comprimido, el método empleado fue una valoración volumétrica basada en una reacción de neutralización o reacción ácido-base. Para ello, se utilizó el hidróxido de sodio como base y la fenolftaleína como indicador visual. Así, tras analizar una media de cinco pastillas por marca y el volumen de NaOH gastado en cada valoración, se procedió a analizar y comparar los resultados obtenidos de concentración de principio activo de cada formulación con los etiquetados.
Los materiales y reactivos necesarios para la elaboración de este estudio fueron los siguientes:

A continuación, se expone el procedimiento seguido para la valoración de cada una de las pastillas de ibuprofeno:

- Pesar cada pastilla en la balanza analítica.
- Machacar la pastilla en un mortero con ayuda del pistilo.
- Pesar cada pastilla en la balanza analítica.
- Machacar la pastilla en un mortero con ayuda del pistilo.
- Para evitar pérdidas de ibuprofeno, añadir 20 ml de etanol en el mismo mortero, echar en un vaso de precipitados y colocar en el agitador magnético para una correcta disolución, aunque es preciso señalar que es muy complicado que se disuelva por completo.
- Verter y enrasar el NaOH (previamente estandarizado utilizando el ácido oxálico como ácido) en la bureta mientras esta permanece cerrada, con la ayuda de un embudo.
- Echar 5 gotas de fenolftaleína a la disolución y colocar debajo de la bureta y sobre el agitador magnético.
- Iniciar la valoración permitiendo que la base caiga gota a gota sobre la disolución de ibuprofeno hasta un color rosa y anotar el volumen de NaOH gastado.
- Repetir el mismo proceso con el resto de los comprimidos de las demás marcas.

Para este experimento, se han tenido en cuenta una serie de consideraciones medioambientales, con el fin de asegurar una correcta gestión de los residuos: las disoluciones de alcohol etílico fueron vertidas a un depósito, localizado en el laboratorio de química del instituto, específico para disolventes orgánicos no halogenados, mientras que la disolución de hidróxido de sodio fue eliminada en otro recipiente exclusivo de disoluciones básicas. Cada uno de estos envases es retirado, posteriormente, por una empresa de recogida de residuos de laboratorio, encargada de gestionar su correcta eliminación.
Cuando se concibe una investigación científica, se debe responder a una necesidad ante la que se buscará la verdad a través del conocimiento, pero es imprescindible que todo tenga un fundamento ético, que garantizará que lo que se realice interfiera lo mínimo posible en la privacidad de la comunidad científica que ha elaborado cada formulación farmacéutica, de ahí que, en nuestro experimento, no se especifiquen las marcas de estos.
Por otra parte, para el desarrollo del experimento se establecieron las siguientes variables:

4. Resultados
A continuación, se muestran los datos obtenidos tras la realización de cinco valoraciones para la determinación de la cantidad de principio activo presente en el ibuprofeno en cuestión:

Tras ello, procedemos a calcular el error cometido, con el fin de obtener una medida lo más precisa posible. Comenzamos hallando el valor medio de los volúmenes de NaOH gastado, el cual tomaremos como verdadero.
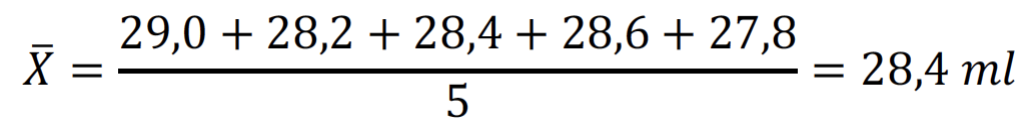
Las desviaciones respecto de este valor son:
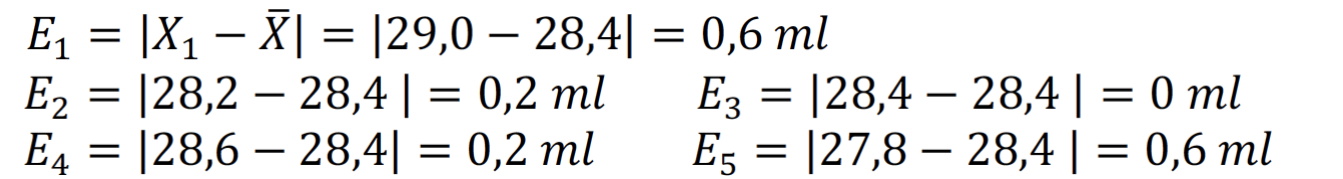
La incertidumbre se calcula como la media aritmética de estas desviaciones. La resolución del instrumento que utilizamos para medir, es decir, de la bureta es de ±0,1 ml; por tanto, la incertidumbre de la medida no podrá ser nunca menor que este valor.
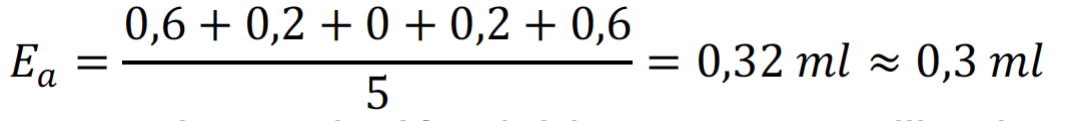
La incertidumbre es mayor que la resolución del instrumento utilizado; por tanto, este valor será el que usaremos para expresar la medida del volumen de hidróxido de sodio gastado en la valoración de la marca 1 de ibuprofeno: (28,4 ± 0,3) ml.
A continuación, con el fin de determinar los moles totales de NaOH empleados, hacemos uso de la molaridad anteriormente calculada, esto es, 0,099 M:
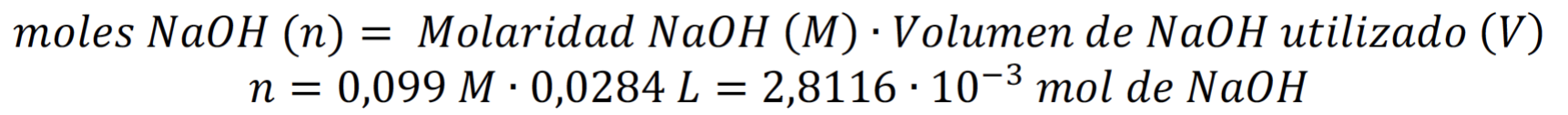
Prosigamos nuestro análisis, hallando los miligramos de ibuprofeno presentes en una pastilla de la marca en cuestión mediante un factor de conversión. Para ello, es útil la estequiometria de la reacción en la que se observa que los moles de NaOH son iguales a los de ibuprofeno.
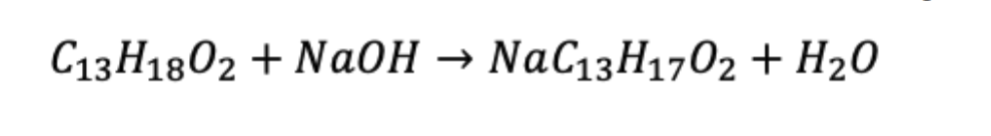
De este modo:
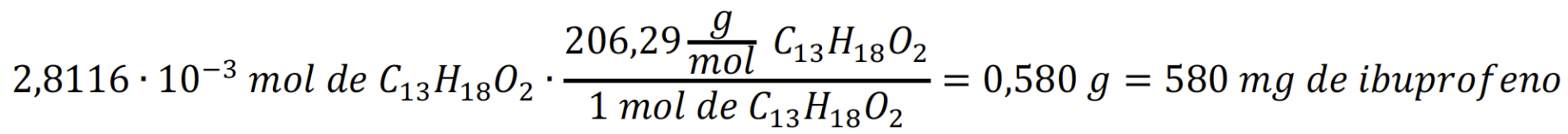
De modo análogo al caso anterior, calculamos el valor medio del volumen de NaOH gastado en el resto de las valoraciones.
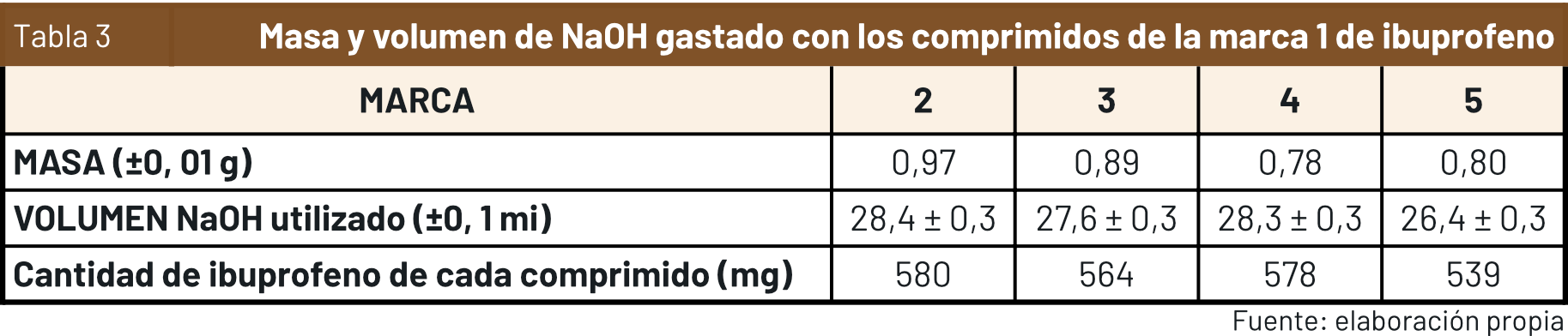
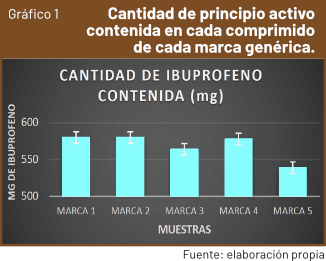
El gráfico que se expone a continuación muestra las diferencias existentes entre la cantidad de principio activo hallada experimentalmente de cada marca genérica en relación al valor de 600 mg supuesto de cada pastilla.
5. Conclusiones
Tras la realización de esta investigación, se podría concluir que no existen diferencias significativas entre un medicamento genérico (marcas 1, 3, 4 y 5) y no genérico (marca 2), a excepción de la disminución en la concentración de ibuprofeno presente en el último de ellos (marca 5) que puede ser debida a que su fecha de caducidad se encuentra más cerca en el tiempo que la de los demás. No obstante, nuestra hipótesis ha sido confirmada, pues ninguna formulación farmacéutica contiene la cantidad de principio activo etiquetado, sino algo menos, y no necesariamente el fármaco más costoso es el más eficiente o el que mejor combate los dolores.
Se debe destacar que, el hecho de que los resultados obtenidos sean menores que los reales, puede explicarse por el error acumulado durante el proceso experimental y el procesamiento de los datos. Estos errores sistemáticos pudieron producirse por la inexactitud de los aparatos de medida, ya que, pese a disponer de todos los instrumentos necesarios en el laboratorio escolar, estos últimos no siempre eran lo suficientemente precisos.
Una de las aplicaciones prácticas que se puede hacer a la exploración que se ha descrito en este informe es la siguiente: las conclusiones obtenidas no solo pueden ayudar a desmentir el mito popular acerca de la marca de ibuprofeno idónea para aliviar los dolores y/o inflamaciones, sino que también contribuye a comprender las limitaciones y errores cognitivos a los que las personas estamos sujetas. Por ello, aunque la perspectiva crítica externa puede ser difícil de lograr, cultivar nuestra capacidad para la duda constructiva es esencial en la continuidad del trabajo y en la producción de conocimiento.
Bibliografía
Azagra, P., Domínguez, P., Molina, J. (n. d). Determinación de Ibuprofeno en formulaciones farmacéuticas genéricas. Facultad de Química, Universidad de Sevilla. - Alonso, T. (2015).
Comparación y características farmacéuticas de comprimidos de ibuprofeno genéricos. Facultad de Farmacia, Universidad Complutense de Madrid.

